Лабораторне заняття 4
biohim
biohim
Мета роботи: сформувати знання про властивості ферментів, вивчити каталітичну дію ферментів та їх роль в живих організмах.
ТЕМА: Вплив температури на активність ферментів. Вплив рH середовища на активність ферментів. Специфічність дії окремих ферментів.
Обладнання і матеріали: штатив з пронумерованими пробірками, градуйовані піпетки, колба, крапельниці, скляні палички, водяна баня, пінцети, розчин Люголя (1г йоду та 2г йодистого калію розчиняють у 15 мл дистильованої води і потім розводять водою до об’єму 300 мл), розчин слини, дистильована вода, стакан з льодом, водяний 0,2% розчин крохмалю, свіжий 3% розчин гідроген пероксиду (H2O2 ), сирі та варені шматочки бульби картоплі.

biohim
ЗМІСТ ТА ПОСЛІДОВНІСТЬ ВИКОНАННЯ ЗАВДАНЬ
Завдання 1. Прочитати теоретичні відомості про ферменти та виконати тести вихідного контролю
ТЕОРЕТИЧНІ ВІДОМОСТІ
Ферменти – це біологічні каталізатори, які прискорюють швидкість хімічних реакцій в живих організмах.
Залежно від просторової структури (рис. 1), ферменти є глобулярними білками.
Розрізняють ферменти однокомпонентні (прості), які складаються лише з амінокислотних залишків та двокомпонентні (складні), які крім амінокислотних залишків містять ще й небілковий компонент (вітаміни, їх похідні, або катіони металів).
Ферменти характеризуються наступними властивостями:
- кожна молекула ферменту здатна здійснювати від кількох тисяч до кількох мільйонів операцій за хвилину, не втрачаючи при цьому своєї структури;
- для проходження ферментативної реакції необхідна досить незначна кількість ферменту;
- ферменти високо специфічні (рис. 2), тобто один фермент каталізує один тип біохімічної реакції;
- активність ферментів змінюється залежно від температури, рН середовища, тиску, концентрації як субстрату, так і самого ферменту;
- під впливом фізико-хімічних чинників (ультрафіолетове опромінення, іонізуюча радіація, висока температура та тиск, солі важких металів, концентровані кислоти і луги тощо) ферменти зазнають денатурації і втрачають каталітичну активність.
Специфічна дія ферменту амілази на крохмаль
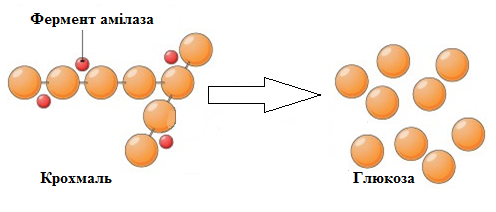
Каталітичну функцію ферменту виконує не вся молекула, а тільки її частина, названа активним центром. Його структура відповідає хімічній будові речовин, які вступають в реакцію. В одній молекулі ферменту може бути кілька активних центрів.
Для хімічної взаємодії молекул потрібна енергія, яка називається енергією активації. Чим менша енергія активації, тим вища швидкість біохімічної реакції. Завдяки активному центру, фермент сполучається з субстратом (речовина, перетворення якої каталізує фермент) і утворюється фермент – субстратний комплекс, в якому фермент змінює молекулу субстрату так, що енергія активації знижується, і вона легше реагує з іншою молекулою (рис. 3). Таким чином, ферменти знижують енергію активації і швидкість реакції зростає. За їх участю біохімічні реакції протікають в 100 – 1000 разів швидше, ніж без них.
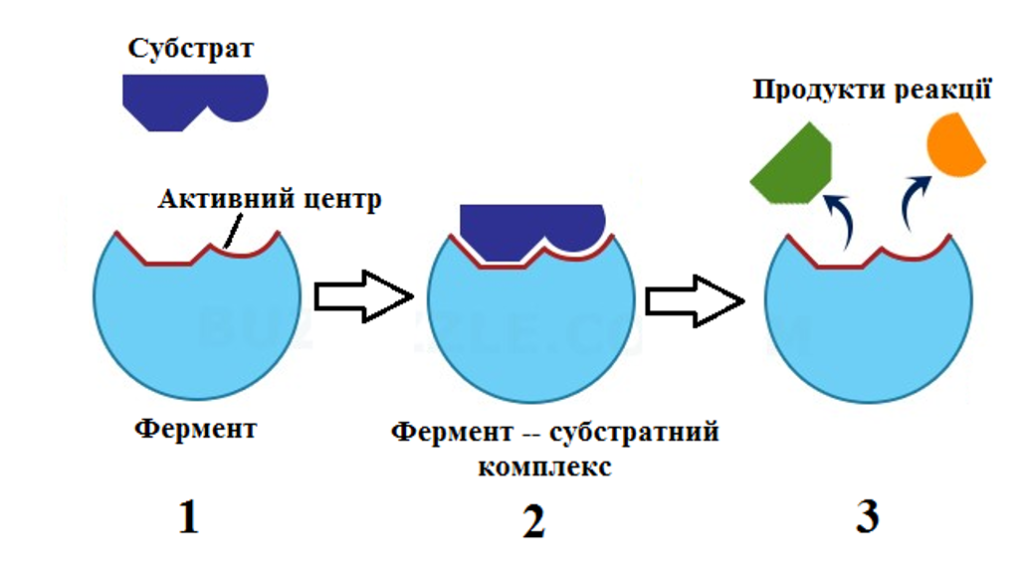
Механізм дії ферменту: 1 – зближення ферменту і субстрату; 2 – взаємодія ферменту та субстрату: 3 – розкладання субстрату на прості речовини |
На швидкість ферментативної реакції впливають різні фактори, насамперед температура, при якій відбувається реакція. Температура, яка забезпечує максимальну активність, називається оптимальною температурою. Якщо температура піднімається вище оптимального рівня, швидкість ферментативної реакції знижується. При температурі близько 70-80 о С ферменти, як правило, необоротно руйнуються. При зниженні температури каталітична активність ферментів зменшується і тимчасово припиняється при температурі нижче 0 о С, а при підвищенні температури їх дія відновлюється.
Деякі ферменти беруть участь в активному транспорті речовин через мембрану.
biohim
ТЕСТОВИЙ КОНТРОЛЬ
(виберіть із запропонованих відповідей одну правильну)
- Прискорення біохімічних реакцій забезпечують:
- алкалоїди;
- гормони;
- вітаміни;
- ферменти.
- Специфічність ферменту щодо речовин, реакцію за участю яких цей фермент каталізує, визначає:
- активний центр;
- вся молекула ферменту;
- небілковий компонент;
- білковий компонент.
- Активність складних ферментів визначається:
- білковим компонентом;
- небілковим компонентом;
- кількість амінокислотних залишків;
- молекулярною масою.
- Після проходження ферментативної реакції ферменти:
- змінюють структуру;
- втрачають активність;
- не змінюють структуру і активність;
- руйнуються.
- Ферменти від інших білків відрізняються:
- є каталізаторами хімічних реакцій;
- є переносниками кисню;
- є поживними речовинами;
- є будівельним матеріалом.
- Принцип, за яким фермент взаємодіє із субстратом:
- доцільність;
- впорядкованість;
- реакційність;
- комплементарність.
Завдання 2. Вивчити каталітичну дію ферментів
Дослід 2.1 Дія ферменту амілази слини на крохмаль
Для виявлення крохмалю використовують розчин йоду. Під дією йоду на крохмаль утворюється речовина синього кольору.
Крохмаль – основний вуглевод нашої їжі. В організмі крохмаль гідролізується. Цей процес починається під час пережовування їжі під дією ферменту слини – амілази. Далі гідроліз триває в шлунку, кишечнику і відбувається ступінчасто. Спочатку утворюються проміжні продукти – декстрини, які з йодом дають забарвлення від синьо-фіолетового до оранжевого. Потім утворюється дисахарид мальтоза. Кінцевим продуктом є глюкоза. Мальтоза і глюкоза не змінюють забарвлення йоду.
Хід роботи:
Дослід 1.
- Сполосніть ротову порожнину 2-3 рази водою. Потім прополощіть 50 мл дистильованої води протягом 3-5 хвилин і зберіть розчин слини в колбу.
- У дві пронумеровані пробірки внесіть по 2 мл розчину крохмалю.
- У пробірку № 1 додайте 0,5 мл розчину слини, а в пробірку № 2 – 0,5 мл дистильованої води. Вміст пробірок перемішайте.
- Пробірки № 1 і № 2 на 15 хвилин при температурі кімнатній температурі.
- Потім до пробірок додайте 2-3 краплини розчину Люголя.
Результат Після додавання розчину Люголя у пробірці 1 забарвлення стане світло синього кольору, це пов’язано з тим що амілаза- фермент слини розчеплює крохмаль на прості цукри.
У пробірці 2 розчин стане яскраво синій або фіолетовий, це свідчить про наявність не розчепленого крохмалю який вступає в реакцію з розчинолм Люголя.
Дослід 2.2 Дія ферменту каталази на гідроген пероксиду (H2O2 )
В клітинах, в процесі окисно – відновних реакцій, утворюється хімічна речовина – гідроген пероксиду (H2O2), яка у великих концентраціях токсично діє на цитоплазму клітин. Накопиченню гідроген пероксиду перешкоджає фермент каталаза, під дією якого H2O2 розкладається на воду і кисень:

Хід роботи:
- Покладіть в пробірку шматочки сирої картоплі і влийте 2 мл розчину гідроген пероксиду (H2O2).- Після додавання в пробірку гідроген пероксиду почнеться виділення бульбашок газу, реакція супроводжується активним шипінням, що вказує на розчеплення (H2O2).
Завдання 3. Дослідити вплив температури на ферменти
Дослід 3.1. Вплив високої температури на каталазу
Хід роботи:
- Покладіть в пробірку шматочки вареної картоплі і влийте 2 мл розчину гідроген пероксиду (H2O2). Реакції не відбудеться, бульбашки газу виділятися не будуть.
Опишіть спостереження. Чи відбуваються зміни? Про це свідчить?
Дослід 3.2.
Вплив температури на активність ферменту амілази слини
Хід роботи:
1.У дві пробірки додайте по 2 мл розчину крохмалю і по 0,5 мл розчину слини.
- Пробірку № 1 залиште при кімнатній температурі, № 2 поставте в стакан із льодом.
- Через 10 – 15 хвилин вийміть пробірки з стакана з льодом і додайте в кожну по 2 – 3 краплини розчину Люголя.
Після додавання розчину Люголя у пробірку 1 розчин або не змінить колір, або стане слабо-синім. Це свідчить про активне розщеплення крохмалю ферментом амілазою, які у слині.
Після додавання розчину Люголя у пробірку 2 розчин стане насичено синім або фіолетовим. Це з тим, що з низької температури активність амілази значно знижена, і крохмаль залишається нерозщепленим.
